生物医药领域传来一则振奋人心的消息:恒润达生生物科技有限公司自主研发的CAR-T细胞治疗产品,其新药临床试验(IND)申请已正式完成国家药品监督管理局药品审评中心(CDE)的技术评审。这不仅是企业自身研发道路上的一座重要里程碑,更标志着我国在细胞技术,尤其是CAR-T这一尖端赛道的研发与应用正朝着产业化与规范化方向迈出坚实而关键的一步。
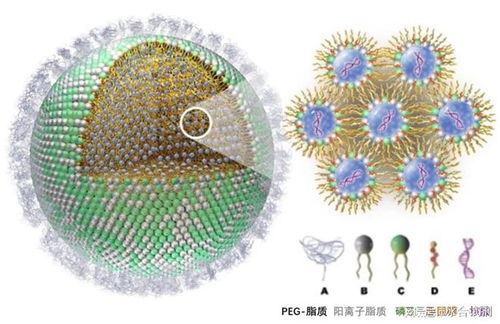
CAR-T(嵌合抗原受体T细胞)疗法,作为近年来肿瘤免疫治疗领域最具突破性的技术之一,通过基因工程手段改造患者自身的T细胞,使其能够精准识别并高效杀伤肿瘤细胞。恒润达生此次IND申请完成技术评审,意味着其产品的药学、非临床研究等核心数据获得了监管机构的初步认可,证明了其在生产工艺、质量控制、有效性及安全性等方面具备了进入临床阶段的基本条件。这背后,是企业对细胞技术从基础研发到工艺开发全链条的深厚积累与不懈攻坚。
技术的突破源于持续的创新与严谨的研发。恒润达生团队在CAR-T产品的研发过程中,很可能在靶点选择、载体构建、细胞扩增工艺以及质量控制体系等环节实现了自主优化与创新。例如,通过设计更安全、更高效的CAR结构,以提升其抗肿瘤活性和持久性;或通过优化体外培养体系,确保细胞产品的均一性与稳定性,为大规模、标准化生产奠定基础。完成技术评审,正是对这些“硬核”技术实力的权威检验与肯定。
从更宏观的视角看,此次进展对我国细胞技术的整体发展具有多重积极意义。它丰富了国内CAR-T治疗的产品管线,为更多血液肿瘤乃至实体瘤患者带来了新的希望。它推动了相关技术标准与审评体系的完善,为后续同类产品的研发与申报提供了宝贵的实践经验与参考路径。它彰显了中国企业在全球细胞治疗竞争格局中的创新活力与成长速度,有助于吸引更多资本与人才投入到这一前沿领域。
完成技术评审只是通向市场的漫长征程中的重要一环。恒润达生的CAR-T产品将正式进入临床试验阶段,这将是检验其真实世界疗效与安全性的最终考场。我们期待这款凝聚着创新智慧的产品能够在临床试验中取得优异成绩,早日惠及广大患者。我们也期待国内产学研各界能以此为契机,进一步加强在细胞存储、自动化生产、降本增效等应用环节的协同创新,共同推动中国细胞治疗产业从“并跑”向“领跑”跨越,让更多“中国智造”的细胞技术成果惊艳世界,守护生命健康。